医療用医薬品の販売情報提供活動に関するガイドライン
平成30年9月25日に厚生労働省より「医療用医薬品の販売情報提供活動に関するガイドライン」(以下、「ガイドライン」という)が公表され、平成31年4月1日から部分適用となりましたが、医薬品製造販売業者等の責務である経営陣の責務、社内体制の整備、モニタリング等の組織体制に関しては、令和元年10月1日から完全適用されます。「ガイドライン」の概要は以下の通りです。
1.ガイドラインの目的
近年、医療用医薬品に関する販売情報提供活動において、証拠が残りにくい行為(口頭説明等)、明確な虚偽誇大とまではいえないものの不適正使用を助長すると考えられる行為、企業側の関与が直ちに判別しにくく、広告該当性の判断が難しいもの(研究論文等)の提供といった行為が行われ、医療用医薬品の適正使用に影響を及ぼすおそれが懸念されています。
「ガイドライン」は、医薬品製造販売業者等が医療用医薬品の販売情報提供活動において行う広告又は広告に類する行為を適正化することによって、医療用医薬品の適正使用を確保し、もって保健衛生の向上を図ることを目的としています。
2.適用範囲等
「ガイドライン」は、医薬品製造販売業者、その販売情報提供活動の委託先・提携先企業及び医薬品卸売販売業者が医療用医薬品について行う「販売情報提供活動」すべてを対象としています。
この販売情報提供活動とは、特定の医療用医薬品の名称又は有効性・安全性の認知の向上等による販売促進を期待して情報を提供することをいい、これには一般人を対象とする疾患啓発広告も含まれます。
また、提供方法や媒体を問わず販売情報提供活動に使用される全ての資料や情報が適用範囲となるため、医薬情報担当者(MR)が口頭で行う説明やモバイルパソコン等の映像を使用した説明、製品説明会においてスライドで説明することも含まれます。
3.販売情報提供活動の原則
「ガイドライン」では、「医薬品、医療機器等の品質、有効性及び安全性の確保等に関する法律」 68条の2に基づいて、医療用医薬品の適正使用のために必要となる情報提供を適切に実施すべきであることに留意することが改めて示されるとともに、販売情報提供活動を行う上での要件、禁止事項、そして推奨事項が下記(1)~(3)のとおり定められました。
(1) 販売情報提供活動は、以下の(1)~(4)の要件を全て満たすこと。
(1)提供する医療用医薬品の効能・効果、用法・用量等の情報は、承認された範囲内であること。
(2)医療用医薬品の有効性のみではなく、副作用を含む安全性等の必要な 情報についても提供し、提供する情報を恣意的に選択しないこと。
(3)提供する情報は、科学的及び客観的な根拠に基づくものであり、その根拠を示すことができる正確な内容のものであること。
(4)販売情報提供活動の資材等に引用される情報は、その引用元が明記されたものであること。
(2) 販売情報提供活動における禁止事項
(1)虚偽もしくは誇大な表現、誤認を誘発させるような表現の使用、その他広告規制において禁じられている行為の実施。
(2)承認された効能・効果、用法・用量等以外の使用方法の推奨。
(3)科学的又は客観的な根拠なく恣意的に、特定の医療用医薬品の処方、使用等の推奨。
(4)他社製品の誹謗、中傷による、自社製品の優位性の訴求。
(5)疾患の罹患や疾病の症状を過度に強調し不安を煽ること。
(6)一般人向けの疾患啓発において、医療用医薬品以外の治療手段がないよう誤認させること。
(7)その他、医療用医薬品の不適正使用又は誤使用を誘発させる表現の使用。
(3)販売情報提供活動において、積極的に取り組むことが推奨される事項
(1)試験結果のみならず試験方法も示し、正確な理解を促すために必要な情報の提供。
(2)比較試験では、試験の設計及び結果の正確な明示及びネガティブな情報の提供。
(3)厚生労働省、独立行政法人医薬品医療機器総合機構(PMDA)から要求された事項に関する情報の提供。
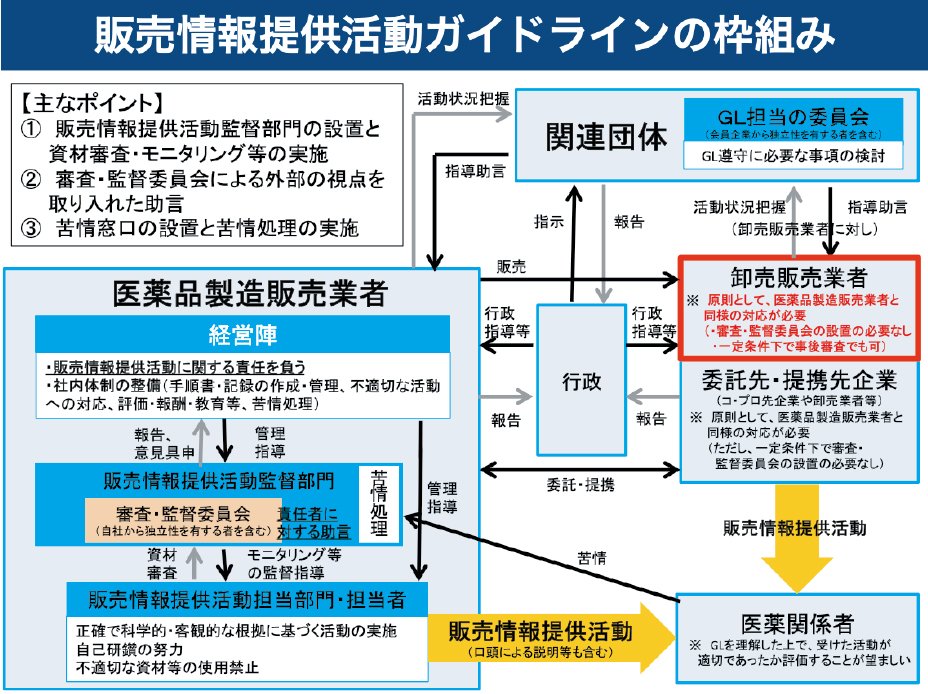
4.医薬品製造販売業者等の責務
経営陣は、自社の全従業員の販売情報提供活動に関する業務上の行動に対して責任を負う必要があり、適切な販売情報提供活動を実施するため、必要な社内体制の整備、担当者等に対する評価、教育の実施、手順書・業務記録の作成・管理及び不適切な販売情報提供活動への対応について、リーダーシップを発揮することが求められています。
社内体制の整備に関しては、販売情報提供活動の資材等や販売情報提供活動自体の適切性等をモニタリング部門(販売情報提供活動監督部門)に販売情報提供活動の担当部門から独立した形で社内に設け、その責任者を明確化し、モニタリング等の監督指導を行うことができる権限を付与することが求められます。モニタリング部門では、定期的なモニタリングを行い、担当部門・担当者に対して必要な監督指導を行います。
販売情報提供活動で使用する資材等は、予め販売情報提供活動監督部門による審査を受けなければならず、審査・監督委員会の助言を踏まえて承認を行い、また販売情報提供活動監督部門は販売情報提供活動の担当部門・担当者が適切な販売情報提供活動を行っているか、定期的にモニタリングも行い、必要な監督指導を行わなければなりません。
また、自社からの独立性を有する者(第三者)を含む審査・監督委員会を設け、販売情報提供活動監督部門の活動に対する責任者に対して必要な助言を行わせます。
販売情報提供活動の担当部門・担当者は、業務を適切に行うために必要な手順書を作成し、業務記録(販売情報提供活動において口頭で説明等を行った内容の 記録を含む。)を作成し、適切に保管させることが必要です。
また、厚生労働省、関係自治体や PMDA から販売情報提供活動に関係する資料の提出を求められた場合には、販売情報提供活動の資材等に加えて手順書や業務記録を提出すること等により、活動状況を速やかに報告させること、及び苦情処理では販売情報提供活動について苦情を受け付ける外部から認識可能な窓口を設けるとともに、苦情があったときは、販売情報提供活動監督部門において迅速に事実関係を調査し、必要な措置を講じさせることが必要となります。
5. 未承認薬・適応外薬等に関する情報提供
未承認薬・適応外薬及び国内では認められていない用法・用量に関する情報提供について、医療関係者または医療関係者以外の国民、患者やその団体から求めがあった場合の提供の際には、下記(1)~(8)に掲げる条件を全て満たす必要があります。
(1)通常の販売情報提供活動とは切り分けて提供すること。
(2)情報提供する内容は、要求内容に沿ったものに限定し、情報提供先は要求者に限定すること。
(3)医療関係者・患者等から情報提供を求められていないにもかかわらず、求められたかのように装わないこと。
(4)提供する情報は、虚偽・誇大な内容であってはならず、科学的・客観的根拠に基づき正確なものでなければならないこと。また、情報提供にあたっては、要約、省略、強調等を行わないこと。
(5)医薬品製造販売業者等による関与があった試験研究の結果やそれに基づく論文等を提供する場合にあっては、当該試験研究が 「医薬品の臨床試験の実施の基準に関する省令」若しくは「臨床研究法」又はこれらに相当するものにより適切に管理されたものであること。
(6)副作用の危険性が高まることや、臨床試験において有意差を証明できなかったこと等、ネガティブな情報についても適切に提供すること。
(7)情報提供する医療用医薬品の効能・効果、用法・用量等が承認を受けていないことを明確に伝えること。
(8)経緯、提供先、提供内容等、情報提供に関する記録を作成し保管すること。
6. 関連団体における対応
関連団体は、会員企業における遵守状況を把握する仕組みを構築し、会員企業に対して必要な指導や助言を行い、会員企業から独立性を有する者が含まれる担当委員会を設置し、会員企業における遵守状況の結果等を踏まえ検討し、結果を公表する必要があります。
参考
【日本ジェネリック製薬協会の対応】
5. 未承認薬・適応外薬等に関する情報提供
簡易懸濁法、粉砕時の安定性等に関する情報提供については、医療関係者が必要とする情報であることに鑑み、現在当局、関連団体で検討中であり、今後の成り行きも含めて留意する必要があります。
6. 関連団体における対応
当協会では、10月より販売情報提供活動対応委員会が対応にあたる予定です。
※JGAニュースNo.137(2019年9月号)掲載後の販売情報提供活動対応委員会の活動
本ガイドラインでは販売情報提供活動の委託先・提携先企業がある場合には、適切な販売情報提供活動の実施のために必要な協力を当該企業から得られるよう契約を締結することが明記されています。
このため、厚生労働省にも意見をいただき、当委員会でこの契約書の雛形を作成しました。
あくまでも参考であり、委託先・提携先との協議等において、本雛形にこだわるものではありません。
(雛形はこちらから)