トピックス
小林化工に歴代最長116日間の業務停止命令
大塚 達也
医薬品の製造工程における数々の法令違反が発覚した小林化工が2月9日、福井県から医薬品医療機器等法(薬機法)に基づき、116日間の業務停止命令を受けた。業務停止期間としては2016年1月8日に化学及血清療法研究所が厚生労働省から受けた110日間を抜き歴代最長となった。小林化工の小林広幸社長は引責辞任の意向を示した。
福井県あわら市にある同社の矢地工場で20年6月24日に製造された抗真菌剤イトラコナゾールの中に睡眠剤リルマザホンが誤混入。当該ロットの製品を処方された患者344人のうち、200人以上にめまいや意識消失など重篤な健康被害が発生し、死亡例も確認された。同剤は製造工程において承認書に記載の手順として認められていない薬剤の継ぎ足しを行っており、その工程において誤混入が起こった。同社に対する調査では、同工場と同市内の清間工場で製造された別の製品においても、承認された手順と製造実態の齟齬、県の定期検査で提示するための虚偽の記録を記した二重帳簿作成、出荷前試験の未実施などの法令違反が確認された。
2005年の薬事法改正で既承認品も含めて承認書に詳細な製造工程を記載することが求められたが、小林社長は総括製造販売責任者を務めていた05年~07年にすでに手順の逸脱や虚偽記録の作成が行われていたことを把握していた。一部変更承認申請などで対応できない製品については承認整理を実施してきたものの、問題のあった全製品をその対象にはできず、多くの製品が問題を先送りにする形で出荷され続けてきた。結局、同社工場で製造される約500品目のうち二重帳簿が作成されていたのは約390品目、承認されていない手順で製造されていたのは約180品目に及んだ。出荷前試験の未実施は一部製品において1970年代後半から存在していた。
こうした点を問題視した福井県から行政処分として「第一種医薬品製造販売業務116日間」「第二種医薬品製造販売業務60日間」「矢地工場にける医薬品の製造業務116日間」「清間工場における医薬品の製造業務60日間」の業務停止命令、あわせて経営陣に責任自覚を促し、法令遵守体制を構築させるための業務改善命令が下された。
小林社長は会見で、社内を含めた関係各所への対応が完了次第辞任する意向を発表した。05年当時から問題を先送りにした理由については、医療現場への混乱を避けようとしたこと、他社からの製造受託案件がまとまりかけていたことなどを挙げ、政府の使用促進策による需要急増などもあり、法令遵守より生産効率を優先させてきてしまったと振り返った。
この問題によって、小林化工は日本ジェネリック製薬協会から会員除名、日本ジェネリック医薬品・バイオシミラー学会から賛助会員除名の処分を受けた。また、2月15日のジェネリック医薬品の承認においても、同社の申請品や製造受託品は薬機法による承認要件を満たしていなかったとして承認されなかった。
第2回 東京都後発医薬品安心使用促進協議会
~当協会(GE薬協)の発表について~
日時:令和3年2月2日(火)18時00分~20時00分
場所:東京都庁第二本庁舎31階特別会議室21【WEB形式】
議事:(1)後発医薬品に関する品質確保~最近の事例より
(2)後発医薬品使用割合の推移
(3)令和2年度の取組の報告
(4)東京都後発医薬品安心使用促進に向けた令和3年度以降のロードマップ案
(5)その他
令和3年2月2日に開催された「第2回東京都後発医薬品安心使用促進協議会」で、当協会(GE薬協)が、昨年末からの抗真菌剤イトラコナゾールへの睡眠剤混入問題等を受けた業界の対応について説明させていただきました。本号では、当日の内容についてご紹介いたします。
会議の冒頭、座長からは、議題「(1)後発医薬品に関する品質確保~最近の事例より」について、重要な内容であるため、急遽、議題に含めた旨の説明がありました。その上で、現状及び今後の対策について業界団体から情報共有いただき、委員の皆と意見交換をしたいとの意向が語られました。
日本ジェネリック製薬協会(以下、GE薬協)からは、冒頭、小林化工の問題に関して同社が当協会の会員会社であること、同社の一件に伴う社会的な混乱に対するお詫びが述べられました。また、今回の一件を受けて同社は、昨年の12月17日時点で当協会の理事職が停止処分となっている旨の説明がありました。これを踏まえ、ジェネリック医薬品の品質に対する従来からの取り組みがどのようなものか、また、昨今起きている事例の経緯を振り返ると同時に、業界で今、どのような取り組みをしているのかについて詳細が説明されました。その後、活発な質疑応答が展開され、参加委員の皆様それぞれの立場から貴重なご意見および情報共有をいただきました。
議題(2)以降では、東京都後期高齢者医療広域連合と東京都薬剤師会、GE薬協が連携して実施予定である新たな試み(新しい切り口での後期高齢者の皆様向け情報発信)について、初めて紹介されました。本会議の閉会に際しては、最後、座長から「ピンチをチャンスに、最終的に患者や社会のためになる活動に繋げていきたいと思う。本日は非常に有意義な情報共有できたことに感謝したい」と締めくくられました。
従来からの医薬品製造に関する取り組みの大原則
従来、品質に関する信頼性の確保は「後発医薬品のさらなる使用促進のためのロードマップ」にも載っており、様々なテーマに取り組んでいるが、まず基本的なGMP、GQPについて冒頭説明させていただく。医薬品の製造業は、先発医薬品、ジェネリック医薬品を問わず、医薬品および医薬部外品の製造管理および品質管理の基準に適合した工場でのみ、製造が許可されている。そのため、厳格な製造管理および品質管理の元で製造されているということになる。
GMPは人為的な誤りを最小限にすることとしており、人為的な誤りをゼロにすることという表現にはなっていない。これは、基本的に製造業はヒューマンエラーが起こり得るからこそGMPに則り、医薬品の製造を適切に行うこととしている。
そして、医薬品が製造販売承認を得るためには、製造所での製造が、GMPの基準に適合していないといけないというルールがある。さらにGMP等の基準の順守状況については、各都道府県に配置されている薬事監視委員等による定期的な査察によりチェックされている。また、製造された医薬品の製剤のサンプルは、保存もされ、出荷後、定期的に品質の変化をチェックすることも行われている。
さらに厚生労働省が、都道府県等の協力の元に実施している、医薬品等の一斉の監視指導において、実際に市場に流通しているジェネリック医薬品を入手した上で、溶出試験等の品質試験、検査により、重点的なチェックを行い、その結果を年度ごとにとりまとめて公表するという仕組みになっている。
重要な点は、2005年の改正薬事法(薬機法)の際に、製造販売制度が導入されその充実が求められたことで、この時の改正薬事法の目玉は2点であった。
一点目は、欧米に合わせて医薬品の製造承認(製造業者)から製造販売承認に切り替わったこと。つまり2005年からは医薬品の製造時点ではなく、販売責任の下で管理することになった。(医薬品の委受託が全面解禁になった年)
二点目は、それ以前の製造承認申請書は、製剤の処方および品質規格を重視した内容であったが、新しい製造販売承認申請書では、これらに加え、原薬や製剤の製造承認、あるいは製造方法、工程管理などを詳しく記載することが求められたことである。
しかし2005年に改正薬事法施行後、残念ながら2015年5月に、化血研で虚偽の製造記録を別途作成していることが発覚し、厚生労働省から業務停止命令が出された。その事件をきっかけに、2016年1月に、医薬品の製造販売承認申請書と実際の製造実態の整合性にかかる点検実施の通達が出され、2016年9月迄に一斉点検を実施した経緯がある。何とその時には、2016年9月迄に479社、22,297品目(医薬品全体の69%)に問題が発覚。残念ながら2005年の改正薬事法以降、適切な対応が出来ていなかったことが明らかになった。
さらにその後、2017年6月、山本化学工業で原薬の製造過程でマスターファイル登録がされていない溶媒や中国製のアセトアミノフェンを混合した事実が発覚。和歌山県から業務停止命令が出された。最近では、2019年12月、協和発酵バイオで今回と同じような医薬品の製造販売承認申請書と異なる製造方法で医薬品の製造を行ったという経緯があり、山口県から業務停止命令が出された。こうした背景のもと、2021年8月、改正薬機法が施行されることになり、総括販売責任者のあり方が明示されることとなった。
今回の一件では、2005年以降の経緯があり、再び同様の問題が起こった。なお、これはジェネリック医薬品に限らず、先発医薬品、原薬の製造に関しては全て同じルールである。
ジェネリック医薬品ならではの取り組み
ジェネリック医薬品に関しては、文献等で品質に問題があると指摘された場合は、国立医薬品食品衛生研究所に設けられた「ジェネリック医薬品品質情報検討会*」で検討され、適宜、品質チェックを実施しその結果を公開している。直近の事例報告では、ジェネリック医薬品の品質上の問題はなかったことを国としても取り上げている。
昨今、ICHガイドラインに鑑み発がん性物質の混入問題が起こった。これについては、これまで発がん性物質が検出されなかったところ、分析機器の向上なども要因となり(ICH‐M7)、合成工程においてニトロソアミン、ラニチジン、ニザチジンなど、先発医薬品と共に、ジェネリック医薬品においても発がん性物質が入り込むことが明らかになり、その対応を行った。現在、該当する製品の多くを販売しているのが、ジェネリック医薬品メーカーであることから結果として、当産業での対応が多発している背景がある。本件もジェネリック医薬品だけの問題ではない。
*現在の名称は「ジェネリック医薬品・バイオシミラー品質情報検討会」
最近の事例、それを踏まえた製薬企業の取り組みについて
恐らく、今回一番関心が高いのは昨年12月に睡眠導入剤の混入が発覚した問題(イトラコナゾール)だと思う。もちろんそれ以外にも供給不安による対応があり、今回の資料ではメーカーの対応や当協会の対応を記載している。冒頭、お話しした通り小林化工は当協会の会員会社である。残念ながら、当協会には新しい情報が頂けていない。
そのような中、昨年12月12日には当協会からプレスリリース「協会会員会社が製造する医薬品の健康被害に関して」を出し、12月28日には当協会の会員会社40社に向けて「医薬品の製造管理、品質管理を徹底する旨」を要請。さらにその後、「具体的にどのような取り組みをしたのかを報告をする」よう要請した。
また今年は、1月18日から「品質関連の問題に関するアンケート調査」を実施。各社の役員、管理職、現場の社員に対してそれぞれ別々に質問する形式のアンケートを実施している。さらに1月26日と27日の2回に分けて、会員会社40社・40名による「総括製造販売責任者(総責)会議」を当協会として開催。同時に、今回問題になっている製造販売承認申請書通りに製造されているかを各社が自主的にチェックしていく方向性を案内した。
なお今回の一件で、厚生労働省経済課から日薬連に対して、医薬品供給調整スキームを発動する要請が出された。特定の会社において市場で30%以上のシェアを持つ製品が1か月間、供給が困難と見込まれたものに関しては、国として関わるメーカーに協力をして頂き、取り組むことになっている。本対応が動き出しており、本日の資料では、対象となる13成分を記載している。これは業界紙の記事を元にまとめたものである。この13成分については、現在、先発メーカーも含め、安定供給にしっかり対応していくための活動が行われており、1成分ごとに対象メーカー間で関係者会議を開催して、増産に向けた対応をしている。
最後に
製造管理、品質管理の問題は2005年の改正薬事法で説明した通り、製薬業界全体の問題として、各社が取り組んでいる。ただし、今回のような睡眠導入剤の混入や、担当者が本来2名でやるところを1名で対応する、あるいは原料を途中で追加するなど承認書にない方法で作業を行う、記録と原料の出納の確認をしない、一部の確認試験を実施していない、出荷の際の確認がおろそかにされ出荷されてしまう、等により起きたのは小林化工個社の問題である。今回の一件では、我々も全容の報告がないため、現時点で分かる範囲でお話しをした。
今回の製造管理、品質管理の問題に対しては、日薬連をはじめ医薬品業界として取り組んでいるが、どうしてもジェネリック医薬品に関しては、安定供給において、ある特定の会社が大きな回収をすると、残りのメーカーでどのように対応するかが大きな課題となる。今回のような有事の際は日薬連の力もお借りしながら製薬業界全体の課題として現在取り組んでいるところである。
業界団体の取り組みに加え、会員各社の積極的な発信も開始されている。今後、こうした発表を各社が行うよう働きかけていく。
(座長)
説明になかったところで、社会からジェネリック医薬品全体について寄せられているいろいろな不安に対し、現時点で業界団体としてPDCAをどのように回しているかを説明してほしい。品質に対する信頼(GMP、GQP)に加え、薬機法に則り販売しているという社会からの信頼という面で、今回の一件を踏まえ、特に社会(本協議会も含めて)に対してしっかりと発信しない限り、安心してジェネリック医薬品を推進するための信頼が回復できないと思われる。信頼回復のための社会への発信という点で、具体的に何をしているか、はじめに教えてほしい。(GE薬協)
全容が見えない中で説明できる部分は限定されるものの、まずは、製造販売承認を得ていることも踏まえ、製造と品質に関しては、この機会に各社に徹底的に点検してもらうよう協会として働きかけている。各社の実態を把握し、点検をどのように行うかについて、協会で統一フォーマットを設けて実施していくことなどが、総括製造販売責任者(総責)会議で協議している。また、各社がそれを遵守してもらうこと。何よりも、このような機会で業界団体としての取り組み、しっかりと逐一、社会に対して具体的に公表していくことで信頼回復に努めたい。<質疑応答(一部)>
(公益社団法人東京都薬剤師会)
今回、GE薬協として、製造販売承認申請書通りに製造されているかを自主的に管理するとあるが、では、今までは行ってきたことは一体何だったのか?また、溶出試験等でジェネリック医薬品の品質に問題がないからという理由で今問題になっている小林化工だけでなく、今多くの製品で回収が発生している日医工など、製造承認書に基づかない対応をしていて、委託か自社製造かも分からないにしても、GMPに基づいた管理を行っていないのではという疑いがどうしても出てくる。こうした点について、GE薬協としてはどのように対応するか教えてほしい。(GE薬協)
まず、製造販売承認申請書と製造の齟齬に関する点検に関しては、点検の仕方について協会としての統一フォーマットを作成し対応することを考えている。各社任せではなく、業界団体として、重要なチェック項目を明示したチェックリストを、今後総括製造販売責任者(総責)会議で作成、平準化して取り組んでもらうことを計画している。(公益社団法人東京都薬剤師会)
GE薬協としてチームを組み、現場に点検に行くなどの取り組みは検討しないのか?そうしたことこそ、不安を取り除く大きな安心材料になるのではないか。(GE薬協)
第三者という形でそうした取り組みについても話が出ている。具体的な取り組みは、今後、方針を定め決めていく。こうした声をいただいたことはしっかりと協会に共有する。(公益社団法人東京都医師会)
小林化工の事件が起きた際、医師への報告が一切なかった。こうしたことは、早期に分かれば、死亡事故までつながらない可能性もある。ヒューマンエラーで起こることは仕方ないが何かあった際の情報提供が必要である。情報提供の徹底は、ぜひともお願いしたい。(GE薬協)
まさに情報提供というところでは、本日の協議会の資料にもある通り、しっかりと厚生労働省から、市場で供給に不安を来すような回収あるいは供給停止をした場合等は、厚生労働省の経済課はもちろんのこと、日本医師会、日本歯科医師会、日本薬剤師会、四病院連絡会、日本医薬品卸売業連合会、日本ジェネリック医薬品販社協会には、事前に報告する旨の通達が昨年12月18日に出ている。これを会員各社に周知徹底するよう取り組んでいる。(公益社団法人東京都医師会)
くれぐれも患者が先に知って、そこから医師が知るということは無いようにしていただきたい。あくまで医師が先に情報を得られるようお願いしたい。(座長)
実際、自身も本件を報道で知り、多くの患者から困惑の声を聞いている。したがって、製造に関する対策だけでなく、今回明らかになったことは、有事の際のリスクコミュニケーションが決定的に欠けていることだと思う。
そしてこれは、氷山の一角に過ぎないということ。
皆様よくご存じの通り、特に病院は医療安全の観点から過去の多くの過ちから学び、事件は隠さず、しかしながらヒヤリハットといって、氷山の一角のニアミスの部分を収集して、改善につなげるというPDCAサイクルを回すようになった。今回の一件をうけ、全容が明らかになっていないとはいえ、氷山の一角でこのようなことになっているので、水面下での取り組みが欠けているように思う。全容が明らかになった時点で具体的な取り組みが決まるものと思うが、現時点でできること、業界内部だけでなく社会に対して発信できることがあるはずなので、ぜひこの点について持ち帰っていただきたい。(一般社団法人東京都病院薬剤師会)
小林化工製品の出荷制限により、入手困難になった。その結果、元の採用薬である先発品を購入せざるを得ない状況となった。今回の一件により、これまで積み上げてきたジェネリック医薬品の国民への啓発の成果がリセットされてしまうのではないかという懸念を持つ。まだ全容が分からず何とも言えないが、やはりコンプライアンス遵守の監視等、何かしら国民の信頼を回復する取り組みを検討していきたい。このところジェネリック医薬品の自主回収がとても多く、それを繰り返すことにも問題意識を持っている。供給面でも安定しているところを優先していきたい。
また、医薬品の安全性情報の報告の重要性をあらためて感じた。医師の鳥居委員からもあったが迅速な報告が必要。自分たち現場も情報を出していかないと、見えないところに事実があるようにも思う。今回の事件は医療機関の先生から発してもらったことで明らかになった。
今後は、ジェネリック医薬品に限らず、様々な角度から医薬品を検討し採用することが重要。採用後、現場で使用する際に医療機関の中で安全性情報を収集することも必要と感じる。薬剤師としても処方提供した現場の先生にフィードバックすることが必要である。そうした細かいことを現場としては行う必要があると感じた。(東京都保険者協議会、東京都国民健康保険団体連合会)
今月がジェネリック医薬品の使用促進月間になっているが、せっかく進めてきた信頼がリセットされる由々しき事態である。チェックの方法はこれまでと同じでは絶対にダメと思う。事件の究明に平行して、今後はこうした事件をゼロにするという心意気で新しいチェック体制の構築に取り組んでほしい。そうでないと被保険者に自信を持ってジェネリック医薬品を薦められなくなる。
なお、今回の件は、ジェネリック医薬品だから起きたでわけではない。報道機関にはどこかの段階で、事件を発表する際に、ジェネリック医薬品だから起きたわけでないことについて言及してほしい。(事務局:東京都健康安全部薬務課)
皆の議論をきいて、ジェネリック医薬品に限らず医薬品業界全体の信頼を覆す大きな事件と感じている。福井県の事業者について東京都がとやかく言う立場ではないが、あえて言わせてもらうと、今回の件は本当に信じがたいこと。皆で築いてきた信頼を覆す事態で薬務課長として誠に遺憾。東京都として対岸の火事と思わず、今一度、信頼を取り戻すべく各会社の法令順守体制を各管理部でも見ていきたい。(公益社団法人東京都薬剤師会)
薬剤師として、どこのジェネリック医薬品が信頼できるのかわからないと、先発品に切り替わって終わりになる。外部の評価機関を入れて工場の管理状況を確認し、その後、GE薬協として推奨できる会員会社はどこかをこの機会だからこそ出せるのではないかと思う。届け出通りに製造しているかを確認する手段は薬剤師会にはない。責めているわけではなくお願いである。(GE薬協)
貴重な意見の数々は、協会にしっかり共有させていただく。こうした声は既に多々出ており、来年度は指標のようなものは出していきたいと考えている。
※委員の皆様の貴重なご意見の詳細については、第2回 東京都後発医薬品安心使用促進協議会の WEBサイトにて、今後、議事録が公開予定です。ぜひご覧いただけますと幸いです。
(ご参考)
東京都「第2回 東京都後発医薬品安心使用促進協議会」
https://www.fukushihoken.metro.tokyo.lg.jp/smph/iryo/kokuho/kohatsuanshin/kohatuiyakuhin/dai2kai_kyogikai_R2.html
日刊薬業
「第三者による各社への立ち入り、GE 薬協に求める意見も 東京都後発品協議会、小林化工問題受け」
https://nk.jiho.jp/article/158555
日本ジェネリック製薬協会
「当協会会員会社における製造管理、品質管理の徹底の不備に起因した品質問題に対する当協会の対応
について」
https://www.jga.gr.jp/assets/uploads/2021/523e1f560b08e98f39590293e059025006ce70be.pdf
当協会会員会社が製造する医薬品の健康被害に関して
https://www.jga.gr.jp/news/201212_004414.html
東和薬品「東和薬品の医薬品に対する製造管理・品質管理への取り組みについて」
https://www.towayakuhin.co.jp/pdf/info210121.pdf
高田製薬「高田製薬の医薬品に対する製造管理・品質管理への取り組みについて」
https://www.takata-seiyaku.co.jp/topics/hs6nik000000t1ok-att/20210129.pdf
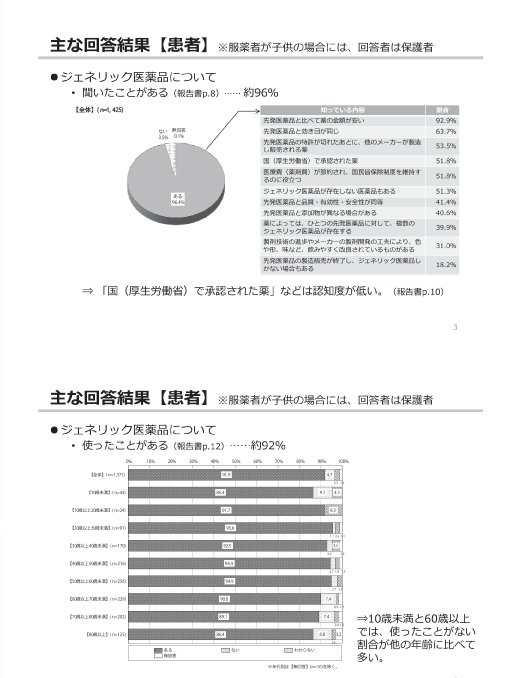
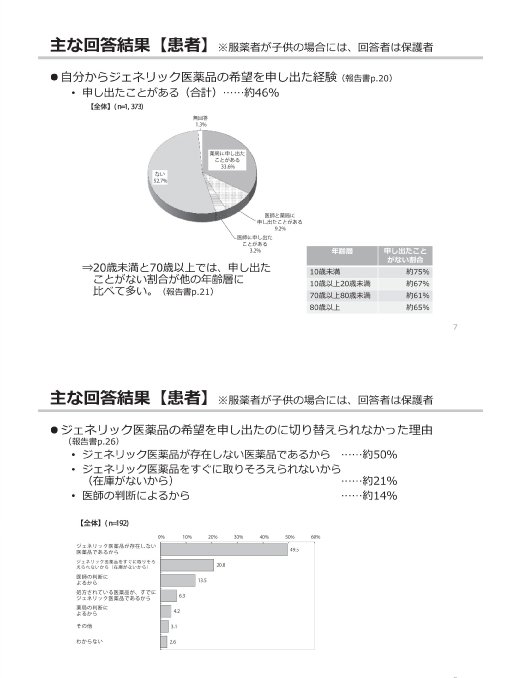
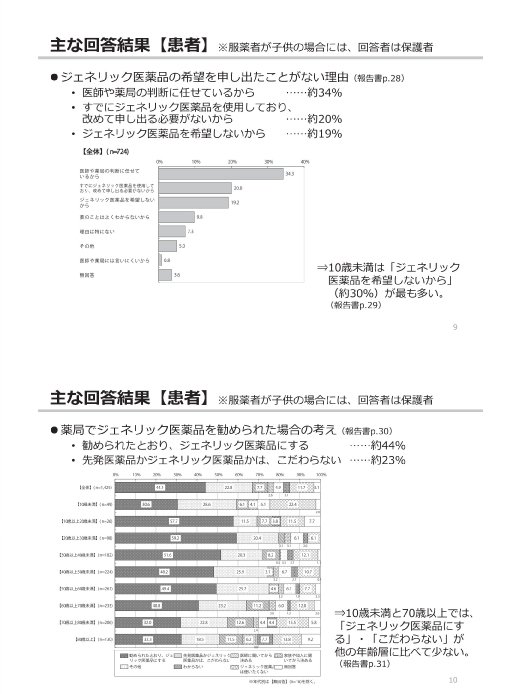
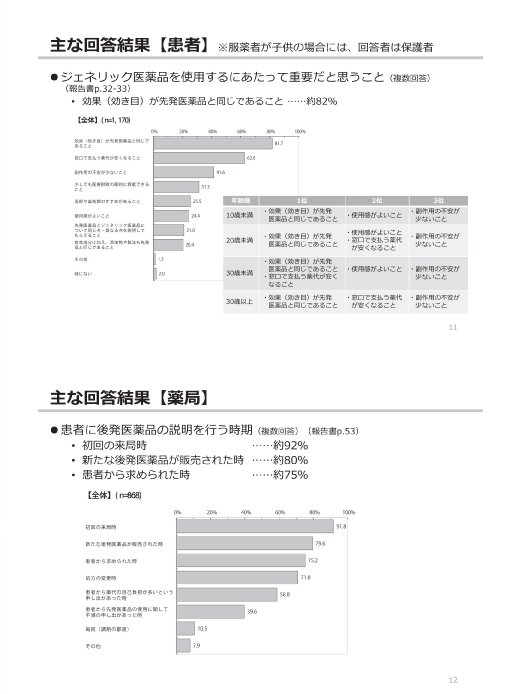
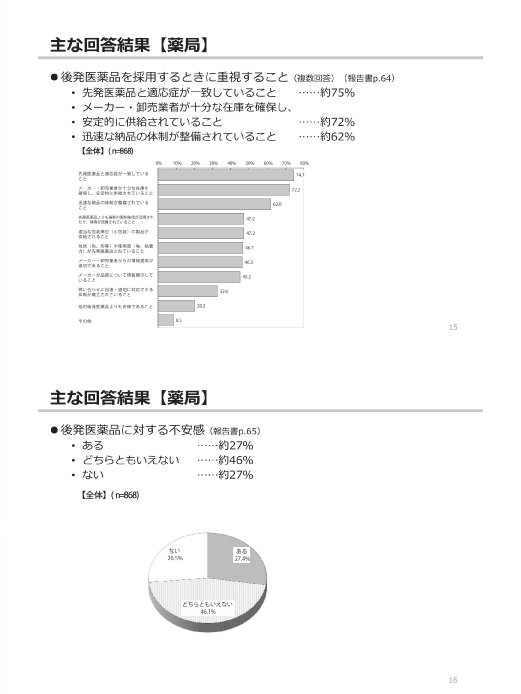
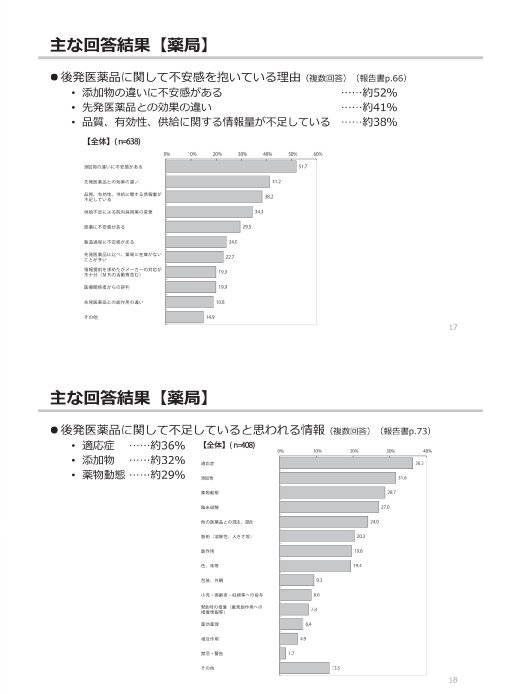
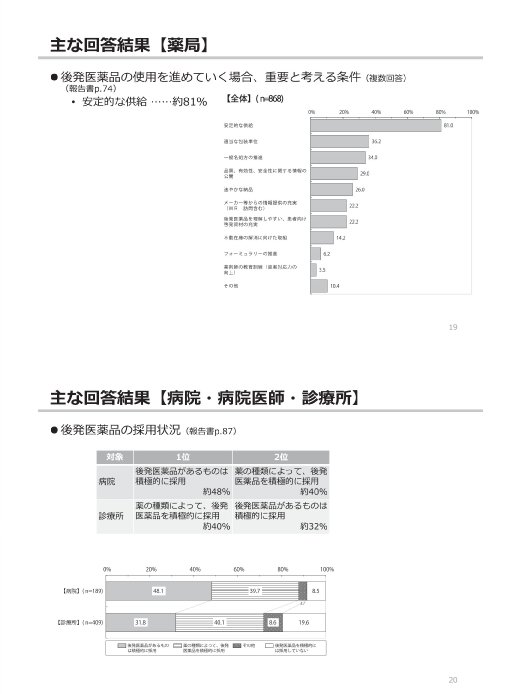
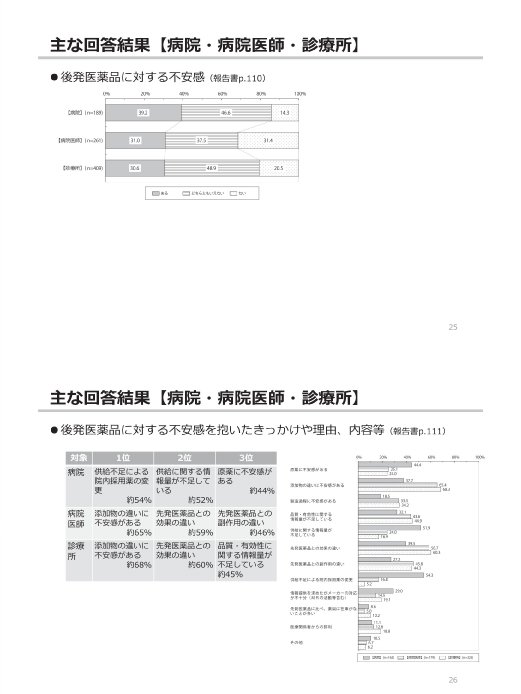
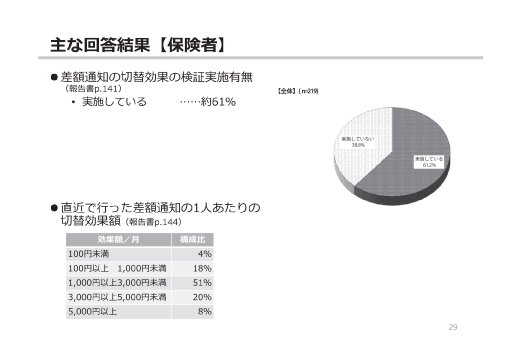
参考:後発医薬品(ジェネリック医薬品)に関するアンケート結果の概要
(出典)
東京都「第2回 東京都後発医薬品安心使用促進協議会」
参考資料 3 後発医薬品(ジェネリック医薬品)に関するアンケート結果の概要
https://www.fukushihoken.metro.tokyo.lg.jp/smph/iryo/kokuho/kohatsuanshin/kohatuiyakuhin/dai2kai_kyogikai_R2.html