第十八改正日本薬局方改正のポイント
第十八改正日本薬局方 (注 1) は、本年 6 月に公示が予定されています。
改正のポイントとして、通則 (注2) と一般試験法 (注3) で影響の大きい項目である元素不純物 (注4)と別名削除 (注5) について紹介致します。
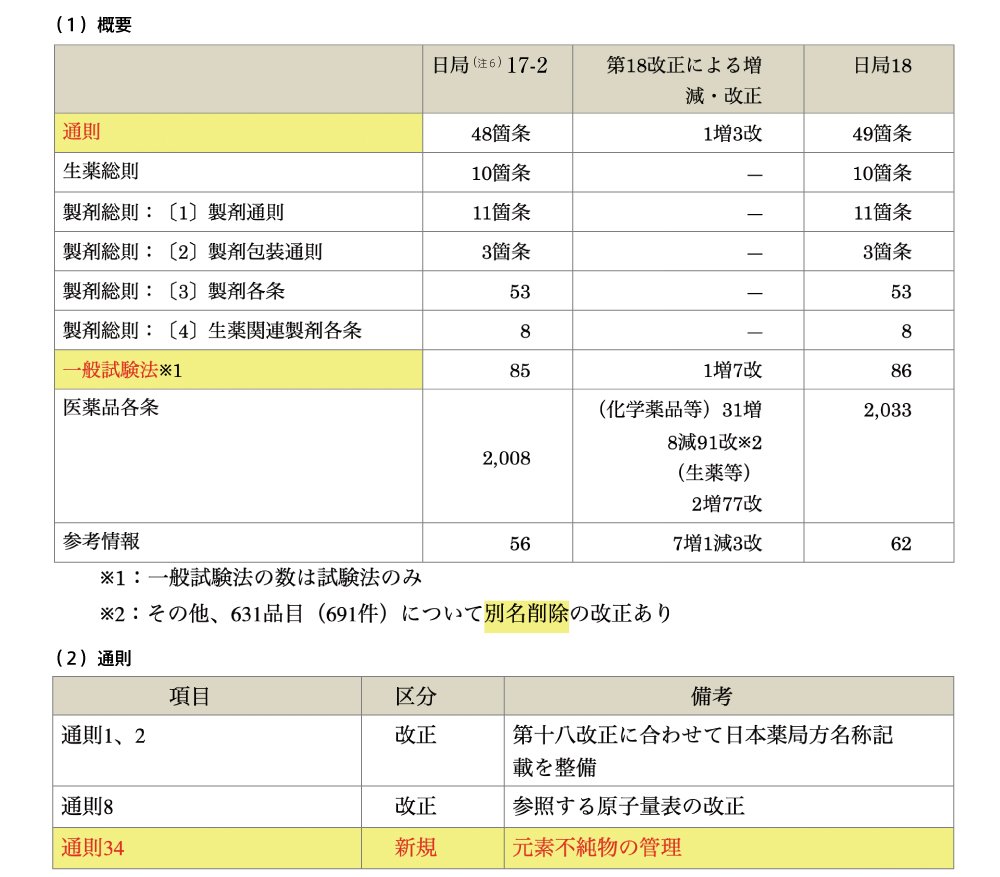
ポイント① 通則34 新規 元素不純物の管理
通則 34
日本薬局方の製剤は,原則として一般試験法の元素不純物に係る規定に従って適切に管理を行う.また,製剤,原薬及び添加剤などにおいて,当該管理を行った場合には,医薬品各条などで規定された重金属,ヒ素など元素不純物の管理は要しない.
元素不純物の管理は、製剤に適用されます(適用される製剤は、一般試験法 元素不純物及び別途通知を参照)。適切に管理されていれば、従来の「重金属,ヒ素」と重複して行う必要は有りません。
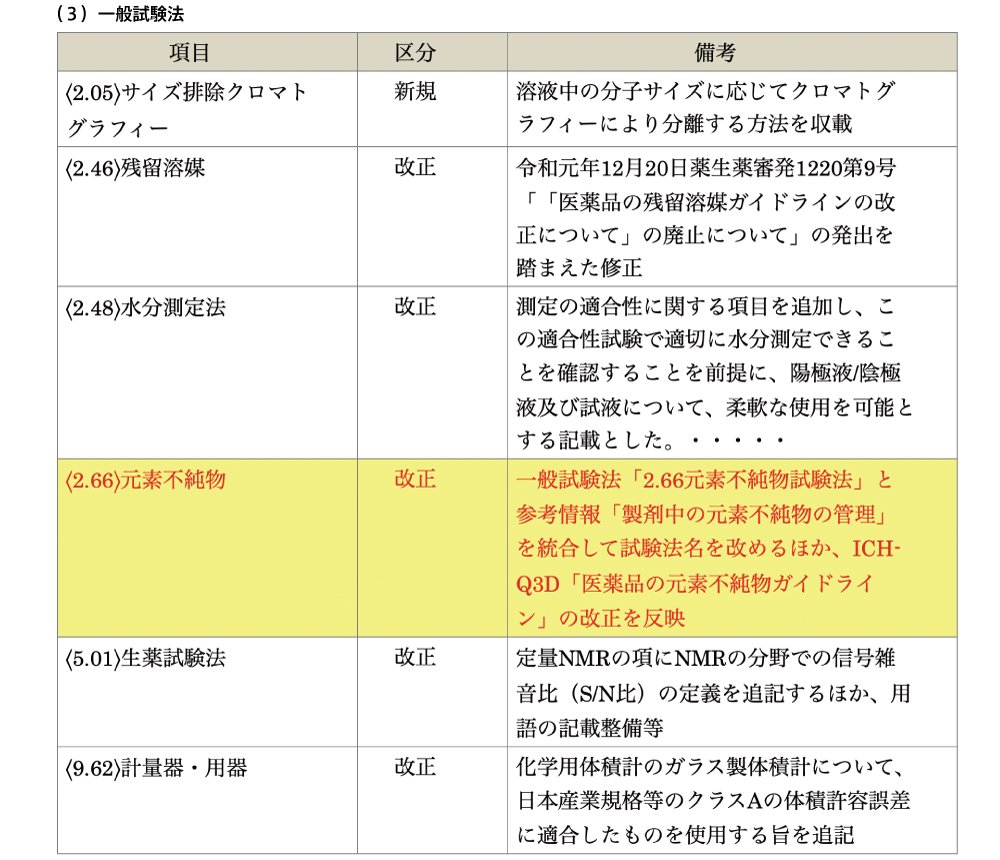
ポイント② 一般試験法 改正 元素不純物
一般試験法〈2.66 元素不純物
一般試験法「2.66元素不純物試験法」と参考情報「製剤中の元素不純物の管理」を統合して試験法名を改めるほか、
ICH-Q3D「医薬品の元素不純物ガイドライン」の改正を反映
第十七改正日本薬局方第二追補において、一般試験法及び参考情報として収載されていましたが、今般、第十八改正で統合されて一般試験法「元素不純物」に名称が改められ、「製剤中の元素不純物の管理」が求められることになります。
令和2年12月28日付け厚生労働省医薬品審査管理課長通知「医療用医薬品に係る元素不純物の取扱いについて」及び同日付け事務連絡「医療用医薬品に係る元素不純物の取扱いに関する質疑応答集(Q&A)について」により、さらに、基本的事項として、適用範囲は、日局収載の医療用医薬品製剤及び局外品製剤となっています。また、適用時期は、告示施行後36か月までに対応することとなっています。医薬品製造販売業者は、ガイドライン通知又は本試験法に基づき、元素不純物についてのリスクアセスメントを行い、適切な管理を行い、その管理状況について説明できることが求められます。
特に、既に承認されている品目については上記課長通知、事務連絡及びガイドライン通知を参考いただき、リスクアセスメントを行い、分析対象の絞り込み、データの取得・解析等、36か月後をゴールとした長期的な計画化が望まれます。
(4)その他
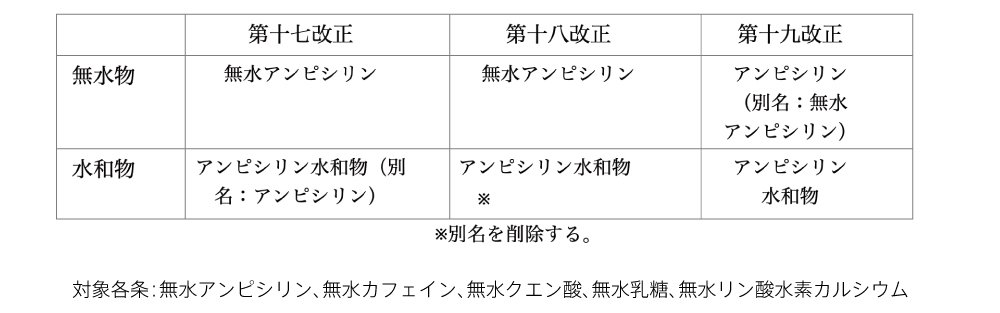
ポイント③ 別名削除と日本名正名の変更
令和元年12月に、削除される別名の一覧(日局18改正対象品目631)がPMDAのホームページに掲載されています。現時点での対策方針として、販売名に別名が入っている承認品目は、販売名変更に伴う新規申請が必要となります。成分分量欄、規格及び試験方法欄等に別名が記載されている承認品目は、ついでの一変申請又は軽微変更届出で対応可の予定です。添付文書の相互作用欄等に別名が記載されている場合は、適宜の自主改訂で差し支えないとなっています。
また、日本名正名の変更として、結晶水 (注7) を有しない品目で「無水〇〇〇」が正名だった5品目について、「無水」の表記が段階的に廃止になります。
例として、
(注1)日本薬局方とは
日本薬局方は、日本における医薬品の品質を適正に確保するために必要な規格・基準及び標準的試験法等を示す公的な規範書であり、厚生労働大臣が国内の専門家、研究者(薬事・食品衛生審議会)の意見を踏まえて定めたものです。現在5年ごとに全面に渡って検討が行われて改正され、第十七改正、第十八改正のように称されます。また5年の間にも必要な一部改正が行われ、第○改正日本薬局方第一追補、第二追補のように称されます。
(注2)通則とは
日本薬局方において、日本薬局方全般に関わる共通のルールを定めている項目です。
(注3)一般試験法とは
日本薬局方において定めている、医薬品各条に共通する試験法、医薬品の品質評価に有用な試験法です。またそれら試験法及びこれに関連する事項を定めている項目の名称でもあります。
(注4)元素不純物とは
医薬品製剤の構成成分中の元素には、原薬や原料の合成において意図的(合成反応に必要なため等)に添加された触媒の残留物や製造設備・器具又は容器施栓系との相互作用に由来するもの等、複数の起源により不純物として存在していることがあります。
従来、こうした不純物は重金属やヒ素として、個別に規定して、必要以上体内に取り込まれないよう日本薬局方で管理
していましたが、更に広範囲な元素の不純物についても管理する必要があるとの国際的な基準(ICH:International Council for Harmonisation of Technical Requirements for Pharmaceuticals for Human Use/医薬品規制調査国際会議)に基づき、新たな元素不純物の管理として、日本薬局方で規定されました。
(注5)日本薬局方における日本名の正名、日本名の別名とは日本薬局方の医薬品各条では、原薬、製剤の医薬品の名称として日本名(正式名称、正名)のほかに、日本名の別名が記載されていることがあります。
日本名の正名とは、原薬の場合は、日本で定められた一般的名称(JAN)の日本語名等を参考に命名されています。例えば、解熱剤のアセチルサリチル酸は日本語読みの化学名ですが、一般的名称「アスピリン」が日本薬局方における日本名(正名)になっています。製剤の日本名は、通例、有効成分(原薬)の名称に剤形を示す名称を付して命名されています。
原薬の日本名が,国際一般的名称(INN)の日本語読み、又は、繁用されている名称と異なるとき。医療の場において広く使われている製剤の慣用名などで特定の商品名に由来しないものがある場合。原薬又は製剤の日本名が改正されたときの改正前の日本名などは、別名として記載できるとされています。今回の改正で削除される別名の多くは過去の「改正前の日本名」です。
(注6)医薬品各条とは
日本薬局方で、個別の医薬品毎に必要な規格と試験方法等を示している項目です。
(注7)結晶水とは
分子やイオンが結晶を形作るときに結晶中に一定の割合で水の分子を含むことがあります。この結晶中に取り込まれた水のことを結晶水といいます。
参考資料
・「医療用医薬品に係る元素不純物の取扱いについて」令和2年12月28日
厚生労働省医薬・生活衛生局医薬品審査管理課長通知
・「医療用医薬品に係る元素不純物の取扱いに関する質疑応答集(Q&A)について」令和2年12月28日厚生労働省医薬・生活衛生局医薬品審査管理課事務連絡
・「医薬品の元素不純物ガイドラインについて」平成27年9月30日厚生労働省医薬食品局審査管理課長通知
・「第十八改正日本薬局方における医薬品各条に掲げた日本名別名の削除について(報告)」の一部訂正について 令和2年6月独立行政法人医薬品医療機器総合機構審査マネジメント部



